Endokrynologia Pediatryczna, Tom 2 | Rok 2003 | Nr 3(4)
DOI: 10.18544/EP-01.02.03.0193
Czy łagodna choroba tarczycy predysponuje do rozwoju raka tarczycy?
Klinika Endokrynologii i Diabetologii Wieku Rozwojowego Akademii Medycznej im. Karola Marcinkowskiego w Poznaniu
Słowa kluczowe: dzieci, łagodna choroba tarczycy, rak tarczycy, niedobór jodu, profilaktyka jodowa
Streszczenie
Zaburzenie biosyntezy hormonów tarczycy może prowadzić do transformacji nowotworowej w tarczycy, jeśli podwyższone stężenie TSH utrzymuje się przez długi czas. Nie można wykluczyć, że defekt genu peroksydazy tarczycowej bierze bezpośredni udział we wzroście tyreocyta i w procesie nowotworzenia. Najczęstszymi pojedynczymi guzkami, które nie mają podłoża nowotworowego, są torbiele, uważane często za łagodną chorobę zwyrodnieniową tarczycy. Duża heterogenność tego schorzenia u dzieci sprawia, iż obejmuje ono zarówno łagodne czyste torbiele, jak też zmiany o charakterze złośliwym w obrębie zmiany mieszanej lito-torbielowatej.
Z obserwacji własnych wynika, że choroba Hashimoto (ZH) może współistnieć z łagodnym nowotworem tarczycy. Jednakże w ostatnich 12 miesiącach odnotowano w naszym regionie trzy przypadki PTC współistniejącego z ZH. Pojawia się pytanie, co zostało zainicjowane wcześniej, zapalenie czy ognisko nowotworowe? Czy profilaktyka jodowa (od stycznia 1997) i związany z nią względny nadmiar jodu są czynnikiem inicjującym zarówno ZH, jak i raka? Czy choroba Graves-Basedowa (G-B) leży pierwotnie u podstaw mechanizmu inicjującego rozwój PTC i tym samym czy PTC jest wtórny do G-B? Istnieje konieczność stałego monitorowania przebiegu autoimmunologicznej choroby tarczycy, jak również ww. łagodnych stanów z uwagi na ryzyko rozwoju raka
Wstęp
Choroba guzkowa tarczycy, pojęcie wprowadzone przez Komisję Endokrynologii Komitetu Rozwoju Człowieka PAN, obejmuje klinicznie wyczuwalny pojedynczy guzek bądź guzki mnogie (wole wieloguzkowe), uogólniony guzowaty charakter gruczołu, jaki spotykamy w przewlekłym limfocytarnym zapaleniu tarczycy oraz tzw. niepalpacyjne guzki tarczycy, które charakteryzują ogniska wykrywane w tarczycy w czasie badania obrazowego szyi [1, 2]. Najczęstszym objawem choroby tarczycy stwierdzanym w badaniu przedmiotowym jest jej powiększenie, czyli wole. Najczęstszą postacią kliniczną przerostu gruczołu tarczowego jest wole proste (obojętne), które definiujemy jako powiększenie tarczycy przebiegające z eutyreozą. Obszar Polski, przez wiele lat o znaczącym niedoborze jodu, może dowodzić, że ma to dominujące znaczenie we wzroście występowania wola prostego u dzieci i młodzieży, a także choroby guzkowej tarczycy (CGT). Awaria reaktora jądrowego, która miała miejsce 26 kwietnia 1986 r. na Ukrainie, obszarze graniczącym od północy bezpośrednio z Białorusią, od zachodu zaś z Polską, mogła stać się dodatkowym czynnikiem patogenetycznym CGT. W zdecydowanej większości guzki mają charakter łagodny, jednak z badań ogólnopolskich i własnych wynika, że udział raka tarczycy w populacji dziecięcej gwałtownie wzrasta [3–5]. Dokładna analiza, zwłaszcza w przypadku zmiany pojedynczej, wymaga ustalenia precyzyjnej diagnozy i prawidłowego postępowania terapeutycznego. Guzki tarczycy identyfikowane są: 1) podczas rutynowego badania klinicznego, 2) mogą być zauważone przez samego pacjenta, 3) stwierdzane w trakcie badania USG powiększonego gruczołu tarczowego lub 4) przypadkowo w czasie wykonywania badań obrazowych z przyczyn pozatarczycowych [1–2, 5].
Wcześniejsze występowanie łagodnej choroby tarczycy (wrodzona niedoczynność tarczycy w przebiegu dyshormonogenezy, torbiel przewodu tarczowo-językowego, wole proste, torbiel, hiperplazja guzkowa, gruczolak pęcherzykowy, przewlekłe limfocytarne zapalenie tarczycy typu Hashimoto, choroba Gravesa) może predysponować do rozwoju raka tarczycy.
Wrodzona niedoczynności tarczycy a rak tarczycy
Wrodzona niedoczynność tarczycy pierwotna (WNT) jest jednym z najczęstszych schorzeń endokrynologicznych w wieku rozwojowym (1:3500-4000 żywo urodzonych noworodków). Jest to również stan predysponujący do rozwoju choroby guzkowej tarczycy. Znane są zarówno ciężkie postaci choroby, jak i takie, których przebieg kliniczny jest umiarkowany czy wręcz łagodny, ujawniający się w późniejszym wieku (późna postać). Istnieje wiele przyczyn WNT, jednak u zdecydowanej mniejszości stwierdza się wole po urodzeniu i wówczas istnieje podejrzenie defektu syntezy hormonów tarczycy, głównie dotyczącego peroksydazy tarczycowej (TPO) [6].
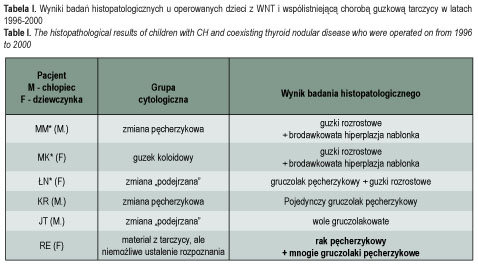
Zaburzenie biosyntezy hormonów tarczycy jest stanem predysponującym do transformacji nowotworowej w tarczycy, jeśli podwyższone stężenie TSH utrzymuje się przez długi czas [7]. Mutację w obrębie eksonu 14 (C-insercję w pozycji 2505-2511) wykryto u noworodka z rakiem tarczycy i z odległymi mnogimi przerzutami [8]. Tę samą nieprawidłowość wykryto u innego dziecka z WNT i gruczolakiem pęcherzykowym [9]. Badania własne wskazują po raz pierwszy, że T-delecja w pozycji 2512 może być odpowiedzialna za rozwój procesu nowotworowego u dziecka z WNT [10]. Być może region 2505-2512 w eksonie 14 genu TPO odgrywa kluczową rolę w predyspozycji do nowotworów tarczycy u dzieci z WNT. Najczęściej występują zmiany guzkowe łagodne u dzieci z WNT (ryc. 1a), ale i wśród naszych podopiecznych stwierdziliśmy raka tarczycy (tabela I) [5].
Torbiel przewodu tarczowo-językowego a rak tarczycy
Torbiele przewodu tarczowo-językowego są najczęstszą anomalią występującą w czasie rozwoju tarczycy [11]. Torbiele te są najczęściej zlokalizowane w lini pośrodkowej, między nasadą języka a kością gnykową, jednakże nie można wykluczyć także lokalizacji śródpiersiowej [12]. Wedug Li Volsi [13] aż 7% populacji ma przetrwałe nieprawidłowości tego przewodu, jednak ryzyko wystąpienia w nim raka tarczycy jest niewielkie, u mniej niż 1% przypadków [14]. Co więcej, rak tarczycy wywodzący się z przewodu tarczowo-językowego jest wręcz unikalny i w literaturze opisano dotąd 8 takich przypadków u dzieci [15]. Badania własne potwierdzają to spostrzeżenie, ale trudno przewidzieć zachowanie się zmiany guzkowej w przebiegu lat. Dzieci, u których wykryto takie zmiany, były leczone operacyjne, w pojedynczych przypadkach dochodziło do regresji samoistnej bądź pod wpływem leczenia L-tyroksyną, co potwierdzałoby zależność ich wzrostu od TSH.
Wole proste a rak tarczycy
Trudno w sposób bezpośredni uznać wole proste za stan predysponujący do rozwoju raka. W pewnych jednak stanach klinicznych, tych przebiegających ze zwiększonym zapotrzebowaniem na hormony tarczycy (okres pokwitania, ciąża, laktacja), ma miejsce nadmierna stymulacja gruczołu i jego powiększenie w związku np. ze względnym niedoborem jodu i/lub hormonów tarczycy. Możemy wówczas zaobserwować podwyższone stężenie TSH, które, jeśli utrzymuje się przez długi okres, może zainicjować proces o charakterze mikroogniskowym. Kliniczna manifestacja tego procesu może ujawnić się po wielu latach jako pojedynczy guzek lub guzki mnogie, najczęściej o charakterze łagodnym.
Torbiel tarczycy a rak tarczycy
Torbiele są najczęstszymi spośród pojedynczych guzków, które nie mają podłoża nowotworowego i często uważane są za łagodną chorobę zwyrodnieniową tarczycy. Jednak nie jest to stwierdzenie do końca słuszne, gdyż duża heterogenność tego schorzenia u dzieci, obejmuje zarówno łagodne czyste torbiele (ryc. 1b), jak też zmiany o charakterze złośliwym. Opracowanie Yoskowitcha [16] na grupie 24 dzieci ze zmianami torbielowatymi wykazało obecność raka w dwóch przypadkach, a gruczolaka pęcherzykowego u czworga dzieci. Dane te jednak nie odnoszą się do tzw. czystych torbieli, a znaczna ich część dotyczy mieszanych ognisk lito-bezechowych, jakże często będących obrazem guzów nowotworowych [5], stąd trudno formułować właściwe wnioski na podstawie tej pracy. Czyste torbiele tarczycy, tak jak każdy inny guzek tarczycy, muszą podlegać standardowej procedurze diagnostycznej z oceną cytologiczną włącznie, a biopsja aspiracyjna cienkoigłowa celowana (BACC) powinna być wykonana pod kontrolą USG, aby ewentualnie pobrać materiał z przyściennych struktur tkankowych, jeśli się je stwierdza [5, 17].
Hiperplazja guzkowa i gruczolak pęcherzykowy a rak tarczycy
Zróżnicowanie guzka rozrostowego (nienowotworowego) od gruczolaka pęcherzykowego może być trudne i niektórzy patolodzy używają określenia guzek koloidowy lub gruczolakowaty. Guzki rozrostowe (ryc. 1c) są z pochodzenia poliklonalne a guzki pojedyncze – monoklonalne i stąd są prawdziwymi nowotworami łagodnymi [18]. Wielokomórkowe pochodzenie (poliklonalność) guzka rozrostowego jest wynikiem proliferacji grup komórek, podczas gdy guz monoklonalny (nowotworowy) formowany jest poprzez proliferację i ekspansję komórki pojedynczej [19].
GP jest nowotworem łagodnym, jednak niektóre jego podtypy uznawane są za potencjalnie złośliwe (GP wywodzący się z kk. Hürtle’a) czy wręcz za postać przedinwazyjną raka pęcherzykowego (GP atypowy – ryc. 1d). Nie można wykluczyć także ryzyka wznowy miejscowej, tak jak w przypadku GP płodowego czy zarodkowego. Z obserwacji własnych w wybranych sytuacjach klinicznych wynika ponadto, że guzy gorące, będące najczęściej gruczolakiem toksycznym, powinny być leczone u młodszych pacjentów wyłącznie operacyjnie vs radiojod w związku z wysokim ryzykiem raka, szczególnie w tzw. nieklasycznych guzkach gorących [20–22]. Te nieklasyczne guzki gorące mogą mieć charakter złośliwy znacznie częściej niż klasyczne i nie można wykluczyć, że patomechanizm odmiennego wychwytu w tych dwóch podgrupach guzów gorących jest wynikiem odmienności molekularnej tkanki guza [22]. W literaturze istnieje określenie „follicular adenoma with an undetermined prognosis” [23]. Obejmuje te przypadki, kiedy w ocenie histopatologa guz nie spełnia kryterium raka pęcherzykowego (inwazja torebki na całej jej grubości i/lub inwazja naczyń), ale stwierdza się pewne niepokojące cechy, jak np.: a) nacieczenie torebki w 1/2 czy w 1/3 grubości, b) obecność prawidłowych tyreocytów w torebce bądź w sąsiadujących węzłach chłonnych, c) wrastanie guza oksyfilnego w pogrubiałą torebkę, ale bez jej przekroczenia, czy też d) obecne utkanie (ognisko) nowotworowe w torebce [5, 23]. Z tego powodu rozpoznania histopatologiczne, które zawierają taki opis badania, wyznaczają kierunek postępowania dla klinicysty, tj. ścisłą obserwację kliniczną, gdyż trudne do przewidzenia jest dalsze zachowanie się pozostawionych komórek tarczycy. Problem to o tyle istotny, że wystąpienie guza tarczycy ma miejsce w tak młodym wieku i stąd prognoza życiowa pozostaje bardzo trudna do określenia [5].
Nieprawidłowy wzrost tarczycy wydaje się być procesem złożonym, zależnym od wielu czynników, głównie TSH Guzy tarczycy rozwijają się u zdecydowanej większości chorych przy braku stymulacji tym hormonem.
Rak tarczycy w przebiegu przewlekłego limfocytarnego zapalenia autoimmunologicznego tarczycy typu Hashimoto
Na podstawie danych literaturowych zapalenie autoimmunologiczne tarczycy uważane jest za stan, który zapobiega ekspansji nowotworu, jeśli stan taki występuje w formie occulta. Z badań własnych wynika, że CGT w ponad 30% pozostawała związana z występowaniem autoimmunologicznego zapalenia tarczycy. Były to głównie postaci przebiegające z rozlanym procesem zapalnym, nie zaś ogniskowym [5]. Współistnienia zapalenia i nowotworu łagodnego nie wykryliśmy u żadnego z operowanych dzieci w okresie 1996-2000, jednakże w latach następnych wykryliśmy zarówno nowotwory łagodne, jak i raki tarczycy (brodawkowate) u dzieci z zapaleniem autoimmunologicznym tarczycy typu Hashimoto (ryc. 1e). Być może należy wiązać to z profilaktyką jodową (od stycznia 1997 roku), powodującą względny nadmiar jodu i ryzyko rozwoju raka, szczególnie brodawkowatego, oraz chorób autoimmunologicznych [24]. Pojawia się pytanie, co było zainicjowane wcześniej, zapalenie, czy ognisko nowotworowe? W chwili obecnej nie można na nie odpowiedzieć. Dane, jakie uzyskano, wydają się nieco podważać stereotyp „ochronnego” działania zapalenia tarczycy. Długotrwała opieka nad dużą liczbą chorych, notabene stale wzrastającą wśród młodych pacjentów, może pozwolić na sformułowanie konstruktywnych wniosków w tym zakresie. Nasza opieka jako endokrynologów dziecięcych kończy się około 19 roku życia i stąd tylko właściwa współpraca i wymiana informacji oraz wiedzy z endokrynologami osób dorosłych może doprowadzić do istotnych spostrzeżeń w przyszłości.
Rak tarczycy w przebiegu choroby Gravesa-Basedowa
Z danych literaturowych wynika, że guzek(i) w G-B może być dość agresywnym w rozwoju rakiem [25–26], podczas gdy w zapaleniu typu Hashimoto guzek może okazać się rakiem, ale w formie occulta [27] lub też może odpowiadać chłoniakowi. Istnieje zatem konieczność stałego monitorowania przebiegu tych dwóch jednostek autoimmunologicznych, a co za tym idzie – dynamiki miana przeciwciał.
Pomimo olbrzymiej liczby dzieci poniżej 19 roku życia z CGT tylko u 1 chłopca z chorobą autoimmunologiczną tarczycy typu G-B rozwinął się rak tarczycy w latach 1996-2000 w regionie wielkopolskim [5, 28]. Przypadek ten potwierdza rzadkość współwystępowania G-B i raka tarczycy u dzieci i, co interesujące, nie był rezultatem długiego czasu trwania choroby i stosowania leków tyreostatycznych, a został rozpoznany u chłopca łącznie z G-B. Ponadto G-B głównie dotyczy dziewcząt, co dodatkowo wspiera unikatowość przypadku. Skoro rak tarczycy miałby być wywołany napromienianiem w związku z katastrofą w Czarnobylu, to zastosowana profilaktyka roztworem Lugola okazała się nieskuteczna, gdyż była spóźniona w stosunku do czasu rozprzestrzeniania się chmury radioaktywnej nad obszarem Polski zachodniej, gdzie chłopiec zamieszkiwał w chwili katastrofy [28–29]. To ostatnie spostrzeżenie jest aktualne także w odniesieniu do innych dzieci z rakiem tarczycy. Drugi przypadek raka brodawkowatego tarczycy, u dziewczynki z G-B, odnotowaliśmy w roku 2001 (ryc. 1f). Pojawia się zatem pytanie to samo, co w przypadku autoimmunologicznego zapalenia tarczycy typu Hashimoto i współistniejącego guzka, tj. czy pierwotna G-B leży u podstaw mechanizmu inicjującego rozwój PTC i tym sposobem PTC jest wtórny wobec G-B? Jest możliwe, że istnieje wspólna linia patogenetyczna tych dwóch zaburzeń lub, być może, mamy do czynienia z dwoma schorzeniami tarczycy o niezależnym pochodzeniu [28]. Istnieje konieczność stałego monitorowania przebiegu autoimmunologicznej choroby tarczycy, jak również ww. stanów łagodnych z uwagi na ryzyko rozwoju raka.
Niepalpacyjne guzki tarczycy jako postać CGT wydają się nie stanowić obecnie zagrożenia w populacji dziecięco-młodzieżowej naszego regionu (jedno operowane dziecko z rozpoznaniem gruczolaka pęcherzykowego, jednakże kwalifikacja do leczenia operacyjnego podjęta została po kilkunastu miesiącach obserwacji i w chwili kiedy guzek był palpacyjny, a obraz cytologiczny „podejrzany”) [30].
BACC musi być czynnikiem decydującym w ustanowieniu ostatecznej decyzji, tak jak w innych postaciach choroby guzkowej tarczycy. Mam nadzieję, że klasyczna ocena cytologiczna wzbogacona badaniami molekularnymi aspiratu z biopsji pozwoli z dużą dokładnością określić ryzyko istnienia zmiany nowotworowej złośliwej w diagnozowanych guzkach tarczycy [5, 31].
Piśmiennictwo
1. Korman E., Niedziela M.; Postępowanie diagnostyczno-terapeutyczne w chorobie guzkowej tarczycy u dzieci i młodzieży; Endokr. Diabet. Chor. Przem. Mat. Wieku Rozwoj. 2000:6, supl. 1, 73-82
2. Korman E., Niedziela M.; Diagnostyka i leczenie choroby guzkowej tarczycy u dzieci i młodzieży; Standardy Medyczne 2001:1 (15), 3, 26-32
3. Korman E., Niedziela M., Rybakowa M. et al.; Thyroid Nodular Disease in Children – a Preliminary Polish Multicenter Study; Horm. Res. 1999:51 (S2), 18
4. Niedziela M., Korman E., Bręborowicz D., et al.; A prospective study of thyroid nodular disease in children and adolescents in western Poland from 1996 to 2000 and the incidence of thyroid carcinoma relative to iodine deficiency and the Chernobyl disaster; Med. Pediatr. Oncol. 2003 (w druku)
5. Niedziela M.; Choroba guzkowa tarczycy u dzieci i młodzieży w regionie wielkopolskim – analiza klinicznych i genetycznych czynników występowania nowotworu. Rozprawa habilitacyjna; Dział Wydawnictw Uczelnianych Akademii Medycznej im. Karola Marcinkowskiego w Poznaniu Poznań 2002
6. Grüters A.; Congenital hypothyroidism; Pediatr. Annals 1992:21, 15-21
7. Medeiros-Neto G., Stanbury J.B.; Inherited disorders of the thyroid system; Boca Raton 1994, CRC Press 207-218
8. Medeiros-Neto G., Gil-da-Costa M.J., Santos C.L.S. et al.; Metastatic thyroid carcinoma arising from congenital goiter due to mutation in the thyroperoxidse gene; J. Clin. Endocrinol. Metab. 1998:83, 4162-4166
9. Kotani T., Umeki K., Yamamoto I. et al.; A novel mutation in the human thyroid peroxidase gene resulting in a total iodide organification defect; J. Endocrinol. 1999:160, 267-273
10. Niedziela M., Ambrugger P., Biebermann H. et al.; TPO gene as a candidate gene in the pathogenesis of thyroid neoplasia of patients with congenital hypothyroidism; J. Endocrinol. Invest. 2001:24, suppl. 6, 43
11. Weiss S.D., Orlich C.C.; Primary papillary carcinoma of a thyroglossal duct cyst: report of a case and literature review; Br. J. Surg. 1991:78, 87-89
12. Reed Larsen P., Davies T.F., Hay I.D.; The thyroid gland. [w]: Williams Texbook of Endocrinology; Red. Wilson J.D., Foster D.W., Kronenberg H.M., Reed Larsen P. 9th edition, W.B. Saunders Company Philadelphia 1998, 389-515
13. Li Volsi V.A., Perzin K.H., Savetsky L.; Carcinoma arising in median ectopic thyroid including thyroglossal duct tissue; Cancer 1974:34, 1303-1315
14. McHenry C.R., Danish R., Murphy T. et al.; Atypical thyroglossal duct cyst: a rare cause for a solitary cold thyroid nodule in childhood; A. Surg. 1993:59, 223-228
15. Patti G., Ragni G., Calisti A.; Papillary thyroid carcinoma in a thyroglossal duct cyst in a child; Med. Pediatr. Oncol. 2000:34, 67-69
16. Yoskovitch A., Laberge J-M., Rodd C. et al.; Cystic thyroid lesion in children; J. Pediatr. Surg. 1998:33 (6), 866-870
17. Lewiński A., Sporny S.; Czy potrzebne jest tworzenie odrębnych standardów u dzieci w postępowaniu diagnostycznym dotyczącym wola guzkowego, nowotworów i zapaleń tarczycy; Endokrynol. Pol. 2001:52, supl. 1 do 4, 76-85
18. Apel R.I., Ezzat S., Bapat B.V. et al.; Clonality of thyroid nodules in sporadic goiter; Diagn. Mol. Pathol. 1995:4, 113-121
19. Wainscoat J.S., Fey M.F.; Assesment of clonality in human tumors: a review; Cancer Res. 1990: 50, 1355-1360
20. Niedziela M., Bręborowicz J., Bręborowicz D. et al.; Rak tarczycy w autonomicznym „guzku gorącym”; Endokr. Diabet. Chor. Przem. Mat. Wieku Rozwoj. 1999:5, 109-112
21. Niedziela M., Korman E.; Guzki gorące jako problem diagnostyczno-terapeutyczny; Endokr. Diabet. Chor. Przem. Mat. Wieku Rozwoj. 2000:6, 21-24
22. Niedziela M., Bręborowicz D., Trejster E., Korman E.; Hot nodules in children and adolescents in western Poland from 1996 to 2000: clinical analysis of 31 patients; J. Pediatr. Endocrinol. Metab. 2002: 15 (6), 823-830
23. Rosai J., Carcangiu M.L., De Lellis R.A.; Tumors of the Thyroid Gland. [w]: Atlas of Tumor Pathology; Red. Rosai J., Sobin L.H., third series, fascicle 5. Armed Force Institute of Pathology, Washington DC 1992, 49-62
24. Niedziela M.; Rola peroksydazy tarczycowej w fizjologii i patologii gruczołu tarczowego; Endokrynol. Pol. 2003 (w druku)
25. Pellegriti G., Belfiore A., Giuffrida D. et al.; Outcome of differentiated thyroid cancer in Graves’ patients; J. Clin. Endocrinol. Metab. 1998:83 (8), 2805-2809
26. Rieger R., Pimpl W., Money S. et al.; Hyperthyroidism and concurrent thyroid malignancies; Surgery 1989:106, 6
27. Loh K.-C., Greenspan F.S., Dong F. et al.; Influence of lymphocytic thyroiditis on the prognostic outcome of patients with papillary thyroid carcinoma; J. Clin. Endocrinol. Metab. 1999:84 (2), 458-463
28. Niedziela M., Korman E.; Thyroid carcinoma in a fourteen-year-old boy with Graves disease; Med. Pediatr. Oncol. 2002:38 (4), 290-291
29. Williams D.; Childhood Thyroid Cancer and Chernobyl; Topical Endocrinol. 1996:2, 10-12
30. Niedziela M., Korman E.; Niepalpacyjne guzki tarczycy – kontrowersje diagnostyczno-terapeutyczne u dzieci; Pediatr. Pol. 2001:LXXVI, 6, 449-454
31. Niedziela M., Maceluch J., Korman E.; Galectin-3 is not an universal marker of malignancy in thyroid nodular disease in children and adolescents; J. Clin. Endocrinol. Metab. 2002:87 (9), 4411-4415