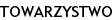Endokrynol. Ped. 10/2011;2(35):49-58
DOI: 10.18544/EP-01.10.02.1314
Interakcje pomiędzy układem adrenergicznym a układem endokrynnym
Klinika Endokrynologii i Neurologii Dziecięcej UM, Lublin
Słowa kluczowe: adrenalina, noradrenalina, układ endokrynny
Streszczenie
Oddziaływanie katecholamin na układ endokrynny można prześledzić na poziomie: podwzgórza (stymulacja noradrenergiczna uwalniania liberyn); w obrębie przysadki (stymulacja adrenergiczna doprowadza na ogół do uwalniania hormonów tropowych); w komórkach gruczołów wewnętrznego wydzielania (bezpośrednie oddziaływanie na syntezę i uwalnianie hormonów). Zilustrowano różną aktywność katecholaminergiczną w różnych zaburzeniach endokrynnych badaniami własnymi
Autonomiczny układ nerwowy (a.u.n.) odgrywa istotną rolę w odpowiedzi organizmu na różne stresory: fizyczne, biologiczne czy psychospołeczne – wpływając na czynność wielu narządów i funkcje metaboliczne organizmu. Układ ten zapewnia regulację funkcji poszczególnych narządów, dostosowanie do wymagań w danej chwili oraz kontrolę środowiska wewnętrznego. Czynności te w dużej mierze nie podlegają kontroli woli.
Funkcjonowanie a.u.n. przejawia się poprzez pobudzenie części adrenergicznej i cholinergicznej tego układu. Każda z osobna cześć a.u.n. może wywierać przeciwne efekty na obwodzie, pobudzające lub hamujące zależnie od jej aktywności. Komórki efektorowe posiadają zazwyczaj unerwienie współczulne i przywspółczulne, i zazwyczaj reagują w przeciwny sposób na pobudzenie każdej z tych części.
Układ adrenergiczny, a więc cześć współczulna a.u.n. wraz z rdzeniem nadnerczy nawet w całkowitym spoczynku wykazuje stałą aktywność toniczną zależną od stałego dopływu pobudzeń z wyższych „pięter” ośrodkowego układu nerwowego (o.u.n.), choć w fizjologicznych warunkach wyraźny wpływ tego układu na funkcjonowanie poszczególnych narządów jest mniej widoczny [1–3].
W literaturze podkreśla się okołodobowe i rozwojowe aspekty czynności adrenergicznej. Dotyczą one rytmu dobowego uwalniania amin katecholowych oraz wzrostu wraz z wiekiem aktywności enzymów biorących udział w syntezie katecholamin [4–6]. Stąd wzrasta wraz z wiekiem zawartość amin katecholowych w o.u.n. i we współczulnych nerwach obwodowych, rdzeniu nadnerczy oraz surowicy i moczu dobowym.
Katecholaminy: dopamina, noradrenalina, adrenalina są uwalniane z komórek chromochłonnych rdzenia nadnerczy na zakończeniach pozazwojowych nerwów współczulnych. Stężenie adrenaliny w osoczu często przewyższa wartość spoczynkową (5–50 pg/ml) oddziaływując na receptory obwodowe. Stężenie noradrenaliny w osoczu rzadko przekracza wartości spoczynkowe (100–400 pg/ml), stąd główne oddziaływanie noradrenaliny związane jest z miejscowym uwalnianiem z zakończeń nerwów współczulnych [7, 8].
Efekt działania amin katecholowych realizuje się poprzez stymulację receptorów adrenergicznych [9] α1, α2, β z co najmniej ich 10 typami [10, 11]. Aktywacja układu adrenergicznego zależy od: liczby receptorów, ich powinowactwa do katecholamin, aktywności biochemicznych szlaków wewnątrzkomórkowych a przede wszystkim od ilości amin katecholowych uwalnianych z rdzenia nadnerczy i zakończeń nerwów współczulnych [1, 12–15]. Inaktywacja katecholamin: wchłanianie zwrotne noradrenaliny (ok. 70%) do zakończeń presynaptycznych i dezaktywacja poprzez MAO; pozaneuronalne wchłanianie głównie adrenaliny uwalnianej do krwi i wewnątrzkomórkowy rozkład przez metylotransferazę-o-katecholową (COMT); dyfuzja noradrenaliny z przestrzeni presynaptycznej do krwi i wydalanie w moczu wraz z adrenaliną w postaci wolnej i związanej z kwasami: siarkowym i glukuronowym.
Oddziaływanie katecholamin na układ endokrynny można prześledzić na poziomie:
– podwzgórza – stymulacja noradrenergiczna uwalniania liberyn;
– w obrębie przysadki – stymulacja adrenergiczna doprowadza na ogół do uwalniania hormonów tropowych; Ryc.1
– w komórkach gruczołów wewnętrznego wydzielania – bezpośrednie oddziaływanie na syntezę i uwalnianie hormonów [16–18].
a. Oddziaływanie układu adrenergicznego na „neurony regulacyjne” podwzgórza: neurony podwzgórza wydzielające hormony uwalniające i hamujące do żył wrotnych przysadki są bogato unerwione przez zakończenia noradrenergiczne [19, 20].
b. Większość badań ewidentnie wskazuje na adrenergiczne unerwienie przysadki i adrenergiczną kontrolę sekrecji przedniego płata przysadki. Mniej wyraźnie dotyczy to układu cholinergicznego [18, 21, 22]. Usunięcie obustronne zwoju szyjnego górnego powoduje zmniejszenie wydzielania FSH, LH, TSH, ale zwiększa indukowane stresem uwalnianie ACTH i prolaktyny [23].
c. Interakcje układu adrenergicznego w komórce narządu endokrynnego. Włókna współczulne biegnące w obrębie narządu kontaktują się bezpośrednio z komórką endokrynną lub zakończenia nerwowe znajdują się w jej pobliżu. Unerwione autonomicznie naczynie krwionośne regulując lokalne ukrwienie – może wpływać na proces syntezy i uwalniania hormonów. Adrenalina (noradrenalina) uwolniona z rdzenia nadnerczy dociera także do narządu endokrynnego drogą krwiopochodną wywołując odpowiedni efekt.
Ścisłe związki pomiędzy a.u.n. a układem wewnętrznego wydzielania dotyczące kontroli stałości środowiska wewnętrznego oraz kontroli ciągłej zdolności adaptacyjnej do otoczenia skłania do obserwacji relacji między tymi układami oraz interpretacji patologicznych zjawisk w organizmie w aspekcie interakcji neurohormonalnej.
Badania własne [24–27] wykazują różną aktywność katecholaminergiczną w różnych zaburzeniach endokrynnych.
Katecholaminy a regulacja wydzielania GH
Badania Al. Damluji [19], Frances i Buonomo [28] oraz Mullera [29] wykazują, że aminy katecholowe są ważnymi stymulatorami α-adrenergicznego uwalniania somatoliberyny, jak również stymulatorami podstawowej, epizodycznej oraz indukowanej sekrecji somatotropiny. Pobudzenie α2 receptorów zwiększa wydzielanie GH (m.in. klonidyna, amitryptylina) prawdopodobnie przez wzrost wydzielania somatoliberyny.
Pobudzenie receptora β-adrenergicznego hamuje wydzielanie GH związane prawdopodobnie ze stymulacją sekrecji somatostatyny [30].
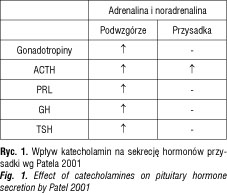
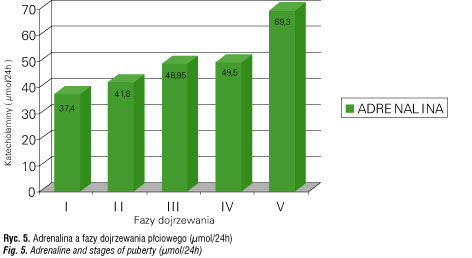
Badania Voorhess i McGillivray [31] oraz własne [32–35] oceniające zachowanie się amin katecholowych u dzieci z niedoborem GH wskazują na słabą aktywność noradrenergiczną mogącą mieć wpływ na małą aktywność sekrecyjną podwzgórzowo–przysadkową i w efekcie na zahamowanie prawidłowego tempa wzrastania (ryc. 2).
Katecholaminy a regulacja wydzielania ACTH i sterydów
Adrenalina pobudza wydzielanie kortykoliberyny i kortykotropiny [36, 37]. Noradrenalina pobudza sekrecję kortykotropiny [38, 39]. Bornstein [40] stwierdził obniżenie uwalniania adrenaliny w chorobie Addisona, z kolei Lenders [41] obniżenie noradrenaliny.
Katecholaminy a kontrola osi podwzgórze–przysadka–tarczyca
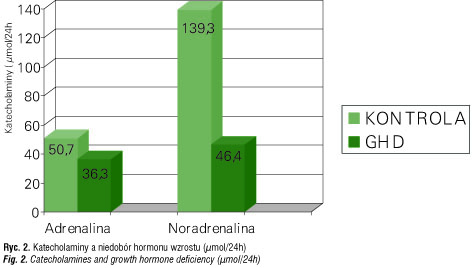
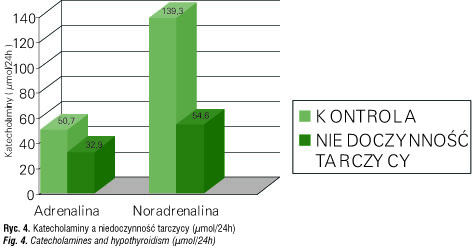
Badania przeprowadzone na zwierzętach sugerują, podobnie jak późniejsze u ludzi, udział receptorów α-adrenergicznych w stymulacji podstawowego i indukowanego zimnem wydzielania TRH i TSH oraz zmniejszenie wydzielania TSH po aktywacji β-adrenergicznej [42–44]. Chociaż spotyka się doniesienia, że są dwie niezależne równoległe drogi [45, 46]. Stwierdzono bogatą obecność zakończeń adrenergicznych wokół naczyń i pęcherzyków tarczycy. Zatem oddziaływanie amin katecholowych na sekrecję hormonów tarczycy zależy od bezpośredniego pobudzenia współczulnego komórek tarczycy i od puli krążących katecholamin, wpływających pośrednio, przez regulację ukrwienia gruczołu [47–53]. Szewczyk i wsp. [54] stwierdzili w nadczynności tarczycy wzrost uwalniania adrenaliny, zaś Burgraaff [55] wzrost uwalniania noradrenaliny (ryc. 3, 4).Wpływ układu adrenergicznego można także prześledzić w ramach obwodowego metabolizmu hormonów tarczycy (m.in. procesy dejodynacji).
Katecholaminy a regulacja wydzielania FSH/LH/gonady
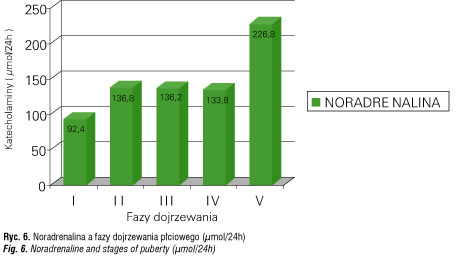
Badania u szczurów wykazały, że neurony wydzielające gonadoliberynę są unerwione przez włókna adrenergiczne. Aktywacja α-adrenoreceptora pobudza, zaś β – receptora hamuje uwalnianie FSH i LH [56–59]. Dane z piśmiennictwa [60] wskazują na stymulacyjną rolę NA na wydzielanie FSH i LH poprzez α-adrenergiczne pobudzenie sekrecji gonadoliberyny, wskazują również na regulację rozwoju jąder i ich funkcji wraz ze wzrostem wydzielania testosteronu pod wpływem amin katecholowych [61–64] (ryc. 5, 6).
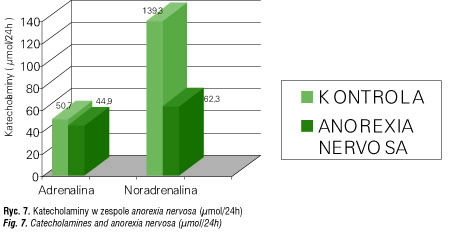
U dziewcząt z zespołem anorexia nervosa i zahamowaniem miesiączkowania obserwuje się obniżoną aktywność noradrenergiczną towarzyszącą obniżeniu poziomu gonadotropin i estradiolu oraz reakcjom subdepresyjnym [65]. Badania własne [66, 67] wykazały nieznacznie obniżone wydalanie adrenaliny oraz zdecydowane obniżenie wydalania noradrenaliny – swoistą „depresję współczulną” (ryc. 7). Sytuacja ta może stanowić podłoże zarówno obniżenia aktywności psychicznej, jak i wielu zaburzeń hormonalnych w tym zespole.
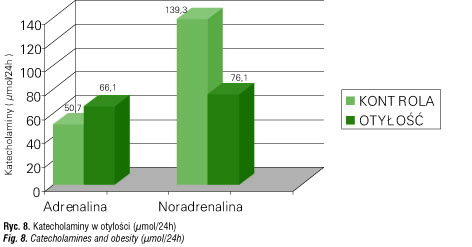
Katecholaminy a otyłość
Mała aktywność katecholaminergiczna – obniżone wydalanie noradrenaliny przy prawidłowym adrenaliny [68] u dzieci z otyłością może wskazywać na słabą stymulację receptorów noradrenergicznych (ryc. 8). Sytuacja ta zmniejsza w efekcie metabolizm tkanki tłuszczowej [69–72]. Mała aktywność noradrenergiczna: zmniejsza aktywność psychoruchową dzieci i ich wydatki energetyczne; powoduje słabą stymulację ośrodka sytości hamującego odczuwanie głodu; wpływa na obniżenie aktywności lipazy i hamowanie lipolizy wewnątrzkomórkowej. Zatem mała aktywność w/w czynników lipolitycznych wydaje się sprzyjać nadmiernemu przyrostowi tkanki tłuszczowej u dzieci z otyłością.
Katecholaminy a cukrzyca typu 1
Wiadomo, że rolę układu adrenergicznego w procesie chorobowym cukrzycy typu 1 można również zauważyć tym bardziej, że wydzielanie komórek beta wysp jest regulowane za pośrednictwem włókien pozazwojowych współczulnych i przywspółczulnych [73–75]. Przyjmuje się również, że insulina odgrywa podobną rolę w stosunku do układu przywspółczulnego jak adrenalina do współczulnego [73].
Na ogół przyjęto pogląd o zaburzeniach funkcji układu autonomicznego w wyniku patologicznego metabolizmu w cukrzycy. Jednak coraz częściej zwraca się uwagę na rolę układu adrenergicznego w patogenezie cukrzycy typu 1 polegającą na hamowaniu wydzielania insuliny przez aminy katecholowe poprzez pobudzenie receptorów typu alfa, zmniejszające zawartość 3,5,AMP [76–78]. Christensen i Neubauer [79] wykazali zdecydowanie wyższą niż w innych narządach zawartość adrenaliny w tkance trzustkowej, zwłaszcza u ludzi z cukrzycą. Badania Abdel-Aziz [80], Gundersona [81], Shade [82] i własne [83] wykazały u dzieci z cukrzycą typu 1 znaczny wzrost wydalania adrenaliny najwyraźniejszy u dzieci z ketoacidozą.
Z kolei autorzy podkreślają spadek pobudliwości układu współczulnego wyrażaną niższą sekrecją noradrenaliny [84–86]. Fakt ten można tłumaczyć jako neuropatię współczulną w przebiegu cukrzycy typu 1 [85, 87, 88].
Podsumowanie
Badania własne dotyczyły dzieci przeważnie w okresie dojrzewania, w okresie labilności neurohormonalnej związanej zarówno z fizjologicznym „skokiem pokwitaniowym” dotyczącym wzrostu aktywności katecholaminergicznej, jak również ze zmienionym – w tym okresie rozwojowym – uwalnianiem hormonów, stąd większa możliwość dysregulacji neurohormonalnej w okresie dojrzewania.
Stwierdzane relacje między aktywnością katecholaminergiczną a zaburzeniami endokrynnymi wskazują na istotną rolę układu adrenergicznego w patomechanizmie wielu zaburzeń czynności układu wewnątrzwydzielniczego w okresie rozwojowym.
Sytuacja powyższa sugeruje możliwość podejmowania prób dotyczących korekcji niektórych zaburzeń wewnątrzwydzielniczych u dzieci, przez oddziaływanie na układ adrenergiczny.
Piśmiennictwo
1. Goldstein D.S.; Physiology of adrenal medulla and the sympathetic nervous system /in/: Principles and Practice of Endocrinology and Metabolism. ed. K, L. Becker; Lippincott Co. Philadelphia 1995, 753-762
2. Goldstein D.S.; Catecholamines and stress; Endocrine Regulation 2003:3, 69-80
3. Trzebski A.; Autonomiczny układ nerwowy i mięśnie gładkie. /w/: Fizjologia człowieka z elementami fizjologii klinicznej. red. W. Traczyk, A. Trzebski,; 1980, 295-352
4. Linsell C.R., Lightman S.L., Mullen P.E. et al.; Circadian rhythms of epinephrine and norepinephrine in man; J. Clin. Endocrinol. Metab. 1985:60, 1210-1215
5. Lal S., Nair N.P.; Neuroendocrine evaluation of catecholaminergic function in man. /in/ Psychoneuroendocrine dysfuncjon. ed. N.S. Schach, A.G. Donald; Iplenum Med. Book Co. NJ. 1994
6. Szewczyk L., Zajączkowska M.; Wydalanie amin katecholowych w moczu u zdrowych dzieci w okresie dojrzewania; Ped. Pol. 1982:57, 305-308
7. Hjemdahl P.; Plasma catecholamines – analitical challengesland physiological limitations. /w/. Catecholamines. Ed. P.M.G. Bouloux; Baillieve Tind. London 1993, 307-354
8. Kopin I.J.; Biochemical assesment of peripheral adrenergic activity. /in/: The Release catecholamines from adrenergic neurons. ed. D.H. Paton; Perg. Press. Oxford N.Y. Toronto 1979
9. Alquist R.P.; A study of the adrenotropic receptors; Am. J. Physiol. 1948:153, 586-591
10. Liggett S.B., Raymond R.; Pharmacology and molecular biology of adrenergic receptors. /w/: Catecholamines; Ed. P.M.G. Bouloux, Bailliere London 1993, 279-306
11. Schilling K., Gratzl M.; Receptors, channels and signal transduction in neurones and endocrine cells. /w/: Autonomic-endocrine interaction; Ed. K. Unsicker. Harvard Acad. Pub. Amsterdam 1996, 13-44. Vetulani 1997
12. Kostowski W.; Hormony a czynność układu nerwowego; PZWL Warszawa 1972
13. Lakatua D.J., Nicolan Y., Bogdan C. et al.; Chronobiology of Catecholamines Excretion n in Different age group. /w/: Advences Chronobiol; A.R. Liss inc. 1987, 31-50
14. Hedberg A.; Adrenergic receptors. Methods of determination and mechanisms of regulation; Acta Med. Scand. 1983, suppl. 672, 7-15
15. Axelrod F.B., Chelimsky G.G., Weese-Mayer D.E.; Pediatric autonomic disorders; Pediatrics 2006, 118, 309-321
16. Audibert A., Lanckranjan I.; The anatomical and phisiological bases of neuro endocrine transmission; Sandoz Basle 1981
17. Lanckranjan I.; Podwzgórzowa i nadwzgórzowa regulacja wydzielania przysadki; Sandoz-Revue 1982:1, 29
18. Patel Y.C.; Neurotransmitters and hypothalamic control of anterior pituitary function. /in/: Endocrinology; Ed. L.J. De Grott, J.L. Jameson, 2001 Saunders Co. Philadelfia 2001, 183-200
19. Al Damluji S.; Adrenergic control of the secretion of anterior pituitary hormones. /in/: Catecholamines; ed. P.M.G. Bouloux 355-392
20. Cunningham E.T., Bohn M.C., Sawhenko P.E.; Organization of adrenergic input to the paraventricular and supraoptic nuclei of the hypothalamus in the rat; J. Com. Neurol. 1990:292, 651-667
21. Cardinali D.P., Romeo H.E.; The autonomic nervous system of the cervical region as a channel of neuroendocrine communication; Frontiers in Neuroendocrinology 1991:12, 278-297
22. Pesce G., Guillaume V., Jeżova D. et al.; Epinephrine in rat hypophysial portal blood is derivet mainli from the adrenal medulla; Neuroendocrinology 1990: 52, 322-327
23. Romeo H.E., Spinedi E., Vacas M.I. et al.; Increalce in adrenocorticotropin release during wallerian degeneration of peripheral sympathetic neurons after superior celvical gangliomnectomy of rats; Neuroendocrinology 1990:51, 213-218
24. Szewczyk L.; Rola układu adrenergicznego w warunkach fizjologicznych i stresie; Ped. Pol. 1984:60, 344-348
25. Szewczyk L., Łozowska A.; Aktywność katecholaminergiczna w zaburzeniach endokrynologicznych okresu dojrzewania; Folia Societatis Sci. Lublin 1987:29, 29-33
26. Szewczyk l.; Aktywność układu adrenergicznego w zaburzeniach endokrynnych u dzieci; Ped. Pol. 1988:63, 639-643
27. Szewczyk L., Duma D., Szewczyk A., Witkowski D.; Catecholaminergic activity and endocrinological disturbances in puberty; Abstracts of VII Symp. Catecholamines Smolenice 1999, 61-62
28. Frances C., Buonomo E.C.; Catecholamine involvement in the control of GH secretion in domestic fowl; Gen. Comp. Endocrinol. 1984:54, 360-367
29. Muller E.E.; Neural control of somatotropic function; Physiol. Rev. 1987:67, 962-969
30. Kelijman M., Frohman L.A.; Beta-adrenergic modulation of GH autofeedback on sleep-asociatet and pharmacologicalli inducet GH secretion; J. Clin. Endocrinol. Metab. 1989:51, 1187-1194
31. Voorhess M.L., Mc Gillivray M.H.; Low plasma NE responses to acute hipoglicemia in children with isolated GH deficiency; J. Clin. Endocrinol. Metab. 1984:59, 790-795
32. Szewczyk L., Niewiedzioł B., Tarkowska A., Zajączkowska M.; Wydalanie amin katecholowych w moczu dobowym u dzieci z niedoborem wzrostu; Endokrynol. Pol. 1987:38, 211-216
33. Szewczyk L., Jaklińska T., Szewczyk A., Tarkowska A.; Test amitryptylinowy w diagnostyce rezerwy przysadkowej u dzieci z niedoborem wzrostu; Endokrynol. Ped. 2002:1, 17-19
34. Szewczyk L., Tarkowska A.; Catecholaminergic and somatotrophine activity in children with short stature; J. Phisiol. Pharmacol. 1995:46, suppl. 1, 91
35. Szewczyk L., Jaklińska T.; Obniżenie aktywności katecholaminergicznej i somatotropinowej u dzieci z niedoborem wzrostu; Endokrynol. Diab. Choroby Przem. Mat. Wieku Rozwój. 1995:1, 37-38
36. Al Damluji S., Rees L.H.; Effects of catecholamines on the secretion of adrenocorticotrophin in man; J. Clin. Pathology 1987:40, 1098-1107
37. Al Damluji S., Francis D.; Activation of central alpha 1-adrenoceptors in humans stimulates secretion of prolactin end TSH as weel as ACTH; Am. J. Physiol. 1993:264, E 208-214
38. Plotsky P. M., Cunningham E.T., Widmajer E.P.; Catecholaminergic modulation of corticotropin-realising factor and adrenocorticotropin secretion; Endocr. Rev. 1989:10, 437-458
39. Kvetnansky R., Pacak K., Fukuhara K. et al.; Sympathoadrenal system in stress; Ann. NY Academy Sci. 1995:771, 131-158
40. Bornstein S.R., Breidert M., Ehrhart-Bornstein M. et al.; Plasma catecholamines in patients with Addison’s disease; Clin. Endocrinol. 1995:42, 215-218
41. Lenders J.W., Golczynska A., Goldstein D.S.; Glucocorticoids, sympathetic activity and presynaptic alfac 2-adrenoceptor function in humans; J. Clin. Endocrinol. Metab. 1995:80, 1804-1808
42. Zimmerman R.C, Krahn L.E., Klee G.G. et al.; Prolonged inhibition of presynaptic catecholamine synthesis with alfa-Methyl-Para-Tyrosine attenuates the circadian rhythm of human TSH secretion; J. Soc. Gynecol. Investig. 2001:8, 174-178
43. Ahren B., Bengtsson H.I., Hender P.; Effect of NA on basal a thyrotropin – stimulatet thyroid hormone; Endocrinology 1986:119, 1058-1062
44. Tuomisto J., Mannuisto P.; Neurotransmitter regulation of anterior pituitary hormones; Pharmacol. Rev. 1985:37, 249-332
45. Bachman E.S., Hampton T.G., Dhillon H. et al.; The metabolic and cardiovascular effects of hyperthyroidism are largely independent of beta-adrenergic stimulation; Endocrinology 2004:145, 2767-2774
46. Ribeiro M.O., Carvalho S.D., Schultz J.J. et al.; Thyroid hormone -sympathetic innervation and adaptive thermogenesis are thyroid hormone receptor isoform-specific; J. Clin. Invest. 2001:108, 97-105
47. Melander A., Sundler F. Westgren U.; Sympathetic innervation of thyroid: variation with species and with age; Endocrinology 1975:96, 102-106
48. Melander A.; Sympathetic control of thyroid function. /in/ Endocrinology, ed. V.H.T.; James Exc. Med. Amsterdam-Oxford 1977, 221-224
49. Nilsson O.R., Karlberg B.E.; Thyroid hormones and the adrenergic nervous system; Acta Med. Scand. 1983, suppl. 672, 27-32
50. Romeo H.E., Boado R.J., Cardinali D.P.; Role of the sympathetic nervous system in the control of thyroid compensatory growth of normal and hypophysektomized rats; Neuroendocirology 1985:40. 309-315
51. Lewiński A.; Neuropeptides and thyroid function and growth. I. Sympathetic and parasympathetic intrathyroidal nervesand coexisting peptides. /in/: Progress in Neuropeptide Research. K.D. Dohler, M. Pawlikowski ed. Birkhauser Ver; Basel 1989, 55-61
52. Lewiński A.; Neuropeptydy a tarczyca; Endokrynol. Pol. 1993:44, 339-403
53. Baryła J., Greniuk G., Łakomy M.; The adrenergic and cholinergic innervation of the thyroid chicken gland; Folia Morphol. 2003:62, 247-250
54. Szewczyk L., Niewiedzioł B., Zajączkowska M.; Akywność układu współczulno-nadnerczowego u dzieci z wolem obojętnym i nadczynnym; Ped. Pol. 1981:56, 1277-1281
55. Burggraaf J., Tulen J.H., Lalezan S. et al.; Sympathovagal imbalance in hyperthyroidism; Am. J. Physiol. Endocrinol. Metab. 2001:281, 190-195
56. Lefkowitz R.J.; Clinical physiology of adrenergic receptor regulation; Am. J. Physiol. 1982:243, E 43
57. Barraclough C.A., Wise P.M.; The role of catecholamines in the regulation of pituitary luteinizing hormone and follicle – stimulating hormone secretion; Endokr. Rev. 1982:3, 91-119
58. Barraclough C.A., Wise P.M., Selmanoff M.K.; A role for hypothalamic catecholamines in he regulation of gonadotrophin secretion; Recent. Prog. Horm. Res. 1984:40, 487-529
59. Ivanisevic-Milovanovic O.K., Pantic V. Demajo M. et al.; Catecholamins in hypothalamus, ovaries and uteri of rats with precious puberty; J. Endocrinol. Invest. 1993:16, 769-774
60. Stjernquist M.; Innervation of ovarian and testicular endocrine cells. /in/: Autonomic-endocrine interactions. ed. K. Unsieker; Harwood Acad. Pub. Amsterdam 1996, 231-256
61. Mayerhofer A., Calandra R.S., Bartke A.; Ciclic adenosine monophosphate does not mediate the stimulatory action of NE on testosterone production by the testis of the golden hamster; Life Sci 1991:48, 1109-1114
62. Szewczyk L., Łozowska A.; Activity of the adrenergic system and the phases of sexual maturation of boys; Frontiers of Paed. Neuroendocrinol London 1993
63. Dluzen D., Attaran C., Liu B.; The effect of estrogen administration in vivo upon catecholamine release in vitro from superfused hypothalamic tissue of ovariectomised prepubertal and adult mice; J. Endocrin. Invest. 1994:17, 855-860
64. Leposavic G., Dash Wood M.R., Ginsburg J., Buckinham J.C.; Peripubertal changes in the nature of the GnRH response to alpha- adrenoceptol stimulation invitro and their modulation by testosterone; Neuroendocrynology 1990:52, 82-89
65. Wuttke W., Honma K., Lamberts R., Hohn K.G.; The role of monoamines in femele puberty; Fed. Proc. 1980:39, 2378-2382
66. Szewczyk L., Tarkowska A.; Catecholaminrgic and opioid state in girls with anorexia nervosa; J. Physiol. Pharmacol. 1995:46, suppl. 1, 91-92
67. Szewczyk L., Jaklińska T., Janowska H.; The changes of catecholaminergic and opioid state in girls with anorexia nervosa during therapy; XXI Intern. Congres of Pediatric Kair 1995
68. Szewczyk L., Łozowska A., Witkowski D., Wysocka-Łukasik B.; Aktywność katecholaminergiczna u dzieci z otyłością prostą; Med. Metab. 1997:1, 62-63
69. Jocken J.W., Blaak E.E.; Catecholamine – induced lipolysis in adipose tissue and skeletal muscle in obesity; Physiol. Behav. 2008:94, 219-230
70. Wahrenburg H., Wenlund A., Arner P.; Adrenergic regulation of lypolisis in fat cells from hyperthyroid and hypothyroid patients; J. Clin. Endocrinol. Metab. 1994:78, 898-903
71. Pinkney J.H., Goodrick S.J. Katz J.R. et al.; Thyroid and sympathetic influences on plasma leptin in hypothyroidism and hyperthyroidism; Internal. J. Obesity. 2000:24, suppl. 2, 165-166
72. Zahorska-Markiewicz B.; Rola autonomicznego układu nerwowego w patogenezie i leczeniu otyłości; Pol. Tyg. Lek. 1995:50, supl. 1, 33-36
73. Himms-Hagen J.; Effects of catecholamines on metabolism /in/ Catecholamines. ed. H. Blaschko, E. Muscholl. Springer Ver.; Berlin NY 1972
74. Holm G.; Adrenergic regulation of insulin release; Acta Med. Scand. 1983, suppl. 672, 21-25
75. Ahren B.; On the peptidergic and aminergic regulation of insulin secretion; Dept. Pharmacol. Lund 1981
76. Czyżyk A.; Rola cyklicznego 3’5’AMP w komórkach beta wysp Langerhansa; Pol. Tyg. Lek. 1972:27, 273-276
77. Galbo H. Christensen H.J., Holst J.J.; Acta Physiol. Scand.; 1977:101, 428-436
78. Porte D.; A receptor mechanism for the inhibition of insuline release by epinephrine in man; J. Clin. Invest. 1967:46, 86-91
79. Christensen N.J., Neubauer B.; Adrenaline in the human pancreas; Acta Endocrinol (Copenh) 1976:82, 757-757
80. Abdel-Azis M.T.; Acata Biol. Med. Ger.; 1975:342, 643-649
81. Gundersen N.J.G., Christensen N.J.; Intravenous insulin causing loss of intravascular water and albumin and increased adrenergic nervous activity in diabetes; Diabetes 1977:26, 551-556
82. Shade D.S, Eaton K.P.; The mechanism of catecholamine induced ketosis in diabetic man; Diabetes 1977:26, 596-601
83. Szewczyk L., Zajączkowska M., Kornas-Dubejko A.; Rola układu adrenergicznego w cukrzycy młodzieńczej; Ped. Pol. 1979:54, 681-685
84. Szewczyk L., Zajączkowska M., Kornas-Dubejko A.; Neuropatia współczulna u dzieci z cukrzycą; Przegl. Ped. 1984, t. 14, 25-27
85. Campbell I.W., Fraser D.M., Ewing D.J. et al.; Peripheral and autonomic nerve function in diabetic ketoacidosis; Lancet. 1976:2, 167-169
86. Ostman J.; Beta-adrenergic blockade and diabetes mellitus; Acta Med. Scand. 1983, suppl. 672, 69-78
87. Mei Q., Mundinger T.O., Lernmark A., Taborsky G.J.; Early, selective and marked loss of sympathetic nerves from the islets of BioBreeder diabetic rats; Diabetes 2002:51, 2997-3002
88. Mundinger T.O., Mei Q., Figlewicz D.P. et al.; Impaired Glucagon response to sympathetic nerve stimulation in the BB diabetic rat: effect of early sympathetic islet neuropathy; Am. J. Physiol. Endocrinol. Metab. 2003:285, E 1047-1054