Endokrynol. Ped. 10/2011;4(37):27-36
DOI: 10.18544/EP-01.10.04.1361
Związek polimorfizmu rs9939609 genu FTO ze wskaźnikiem masy ciała u dzieci z cukrzycą typu 1
1Klinika Pediatrii, Endokrynologii, Diabetologii z Pododdziałem Kardiologii Uniwersytetu Medycznego w Białymstoku
2Zakład Patomorfologii Lekarskiej Uniwersytetu Medycznego w Białymstoku
3Klinika Pediatrii Uniwersytetu Medycznego w Warszawie
4Klinika Pediatrii, Onkologii, Hematologii i Diabetologii Uniwersytetu Medycznego w Łodzi
5Katedra i Klinika Pediatrii, Endokrynologii i Diabetologii Dziecięcej Śląskiego Uniwersytetu Medycznego w Katowicach
6Katedra i Klinika Pediatrii, Hematologii, Onkologii i Endokrynologii Uniwersytetu Medycznego w Gdańsku
7Katedra i Klinika Endokrynologii i Diabetologii Wieku Rozwojowego Akademii Medycznej we Wrocławiu
8Klinika Pediatrii, Endokrynologii, Diabetologii, Chorób Metabolicznych i Kardiologii Wieku Rozwojowego Pomorskiego Uniwersytetu Medycznego w Szczecinie
Słowa kluczowe: gen FTO, otyłość, cukrzyca
Streszczenie
Wstęp. Dzięki intensywnym badaniom genomu ludzkiego wykazano związek pomiędzy polimorfizmem wybranych genów, w tym genu FTO (fat mass and obesity-associated gene), a obecnością czynników ryzyka chorób układu sercowo-naczyniowego, w tym otyłości. Czynniki te występują bardzo często wśród dzieci, młodzieży i młodych dorosłych z cukrzycą typu 1. Za cel opracowania przyjęto próbę określenia związku pomiędzy polimorfizmem rs9939609 genu FTO a wartościami wskaźnika masy ciała i cechami związanymi z otyłością u dzieci z rozpoznaniem cukrzycy typu 1. Materiał. Do badania zakwalifikowano 553 dzieci z rozpoznaniem cukrzycy typu 1 oraz 405 dzieci bez cukrzycy (grupa odniesienia). Metoda. Polimorfizm FTO rs9939609 oznaczono u wszystkich dzieci metodą dyskryminacji alleli na aparacie ABI 7900HT Fast Real-Time PCR System. Wyniki. 1. Wśród dzieci z cukrzycą typu 1 w porównaniu do dzieci bez cukrzycy zanotowano wysoki odsetek nadwagi/otyłości oraz cech zespołu metabolicznego. 2. Wykazano związek polimorfizmu genu FTO ze wskaźnikiem masy ciała oraz stężeniem triacylogliceroli zarówno u dzieci z cukrzycą, jak i w grupie odniesienia, natomiast związek z obwodem talii oraz wartościami ciśnienia skurczowego krwi obserowano wyłącznie u dzieci bez cukrzycy. Wniosek. Po raz pierwszy w literaturze zaobserwowaliśmy związek polimorfizmu rs9939609 genu FTO ze wskaźnikiem masy ciała u dzieci z cukrzycą typu 1. Być może uzyskane przez nas wyniki pozwolą na identyfikację grup pacjentów zagrożonych zwiększonym ryzykiem rozwoju chorób układu sercowo-naczyniowego wśród młodych pacjentów z cukrzycą
Wstęp
Epidemia otyłości u dzieci stała się w ostatnich dekadach istotnym problemem medycznym i społecznym (www.who.int). Jej uwarunkowania środowiskowe i genetyczne, a także metody diagnostyczne i terapeutyczne stosowane w tym schorzeniu są przedmiotem zainteresowania wielu badaczy [1, 2].
Do rozpoznawania nadwagi i otyłości u dzieci powszechnie używa się wskaźnika masy ciała [3]. Jego standaryzowane wartości oraz przedziały centylowe dla dzieci polskich zostały niedawno zaktualizowane [4]. Poza takimi czynnikami, jak nieprawidłowa dieta oraz niska aktywność fizyczna, w patogenezie otyłości istotną rolę odgrywają uwarunkowania genetyczne. Jednak skala ich wpływu nie jest znana [5]. Dzięki intensywnym badaniom genomu ludzkiego wykazano związek pomiędzy polimorfizmem wybranych genów a obecnością czynników ryzyka chorób układu sercowo-naczyniowego, w tym otyłości [6]. Jednym z największych sukcesów w tej dziedzinie jest odkrycie wpływu niektórych wariantów pierwszego intronu genu FTO (fat mass and obesity associated gene) na występowanie otyłości zarówno u dorosłych, jak i u dzieci [7]. Dorosłych nosicieli obu alleli A w miejscu rs9939609 charakteryzują: wyższa o 3 kilogramy masa ciała oraz 1:67 wyższe ryzyko otyłości w porównaniu do nosicieli obu alleli T [7]. W niektórych grupach pacjentów wpływ ten jest silniejszy niż w ogólnej populacji [8]. Funkcja białka kodowanego przez gen FTO nie jest znana, najbardziej prawdopodobne jest jego działanie na ośrodkowy układ nerwowy [9]. Mechanizm związku polimorfizmu genu FTO z wartościami masy ciała oraz wskaźnika masy ciała również nie jest wyjaśniony, ale najprawdopodobniej obejmuje przyjmowanie większej ilości kalorii poprzez wybieranie przez nosicieli alleli A potraw wysokokalorycznych z dużą zawartością tłuszczu oraz upośledzone uczucie sytości [10–12].
Cukrzyca typu 1 (T1D) jest jedną z najbardziej rozpowszechnionych chorób przewlekłych w populacji wieku rozwojowego, a częstość zachorowań wśród dzieci rośnie [13]. Podstawowe składowe leczenia T1D to insulinoterapia, dieta, wysiłek fizyczny, samokontrola oraz edukacja. Nowoczesna terapia funkcjonalna z użyciem osobistej pompy insulinowej, wprowadzona powszechnie w ostatnich latach, prowadzi do poprawy wyrównania metabolicznego, mniejszej ilości incydentów hipoglikemii oraz poprawy jakości życia pacjentów [14]. Jednak leczenie insuliną może skutkować nadmiernym przyrostem masy ciała (mechanizm tego zjawiska opisano w [15]). Otyłość oraz inne czynniki ryzyka rozwoju chorób układu sercowo-naczyniowego występują bardzo często wśród dzieci, młodzieży i młodych dorosłych z cukrzycą typu 1 [16–18]. Zgodnie z danymi z literatury należy zakładać, że większość dzieci z otyłością będzie również cechowała się nadmierną masą ciała w wieku dorosłym [19]. Istnieje zatem potrzeba identyfikacji pacjentów z grup ryzyka zagrożonych tą patologią w celu podjęcia prób interwencji terapeutycznej. Należy pamiętać, że schorzenia układu sercowo-naczyniowego są główną przyczyną chorobowości i śmiertelności wśród dorosłych pacjentów z cukrzycą.
Zgodnie z naszą wiedzy nie ma danych dotyczących wpływu podłoża genetycznego na pojawianie się otyłości oraz innych czynników ryzyka rozwoju chorób układu sercowo-naczyniowego w grupie pacjentów z cukrzycą typu 1. Zatem za cel niniejszego opracowania przyjęto próbę określenia związku pomiędzy polimorfizmem rs9939609 genu FTO a wartościami wskaźnika masy ciała i cechami związanymi z otyłością u dzieci z rozpoznaniem cukrzycy typu 1. Określenie takiego związku mogłoby w przyszłości pomóc identyfikować pacjentów zagrożonych otyłością oraz jej konsekwencjami.
Pacjenci
Badanie jest częścią projektu FTO-DIAB, którego celem jest wyjaśnienie podłoża genetycznego obecności czynników ryzyka chorób układu sercowo-naczyniowego u dzieci z cukrzycą typu 1. Projekt jest koordynowany przez Klinikę Pediatrii, Endokrynologii, Diabetologii z Pododdziałem Kardiologii Uniwersytetu Medycznego w Białymstoku, a realizowany przez ośrodki diabetologii dziecięcej w całej Polsce. Na realizację badania uzyskano zgodę Komisji Bioetycznej Uniwersytetu Medycznego w Białymstoku. W każdym przypadku rodzice/opiekunowie dziecka wyrażali zgodę na udział w badaniu. Projekt zarejestrowano na www.clinicaltrials.gov pod numerem NCT01279161. Do wstępnej analizy w okresie od listopada 2009 do grudnia 2010 r. zakwalifikowano 553 dzieci z rozpoznaniem cukrzycy typu 1 oraz 405 dzieci bez cukrzycy (grupa odniesienia). Kryteria włączenia do grupy badanej obejmowały: rozpoznanie cukrzycy typu 1 (wg Polskiego Towarzystwa Diabetologicznego łącznie z oceną przeciwciał), wiek 4–18 lat oraz leczenie przez co najmniej rok ustalonym schematem insulinoterapii (funkcjonalna insulinoterapia z zastosowaniem penów lub osobistej pompy insulinowej). Kryteria włączenia do grupy odniesienia stanowiły: wiek 4–18 lat, zgoda rodziców/opiekunów, wykluczenie cukrzycy (wywiad, badanie przedmiotowe, glikemia w osoczu na czczo). Najczęstszymi powodami hospitalizacji dzieci z grupy odniesienia były: szmer nad sercem i zaburzenia rytmu serca, wady serca nieistotne hemodynamicznie, nadwaga/otyłość prosta oraz nadciśnienie tętnicze. Z badań (zarówno w grupie badanej, jak i odniesienia) wykluczono dzieci z chorobami chromosomalnymi, celiakią, zaburzeniami czynności tarczycy, nadnerczy, gonad, zaburzeniami odżywiania (w tym anorexia nervosa i bulimia) oraz innymi chorobami mogącymi wpływać na masę ciała; pacjenci nie przyjmowali żadnych leków (poza insuliną w grupie badanej).
Metody
W grupach badanej i odniesienia zostały ocenione następujące parametry:
a. dane antropometryczne: wiek, płeć, wzrost, masa ciała, wskaźnik masy ciała (BMI) i standaryzowany wskaźnik masy ciał (SDS-BMI) oraz obwód talii;
b. badania dodatkowe: ciśnienie krwi (średnia z trzech pomiarów), profil lipidowy tj. cholesterol całkowity, HDL-cholesterol, LDL-cholesterol, triacyloglicerole w surowicy.
U dzieci z cukrzycą do oceny przyrostu masy ciała jako wyjściowy przyjęto wskaźnik masy ciała z okresu 3–6 miesięcy od rozpoznania zgodnie
z danymi literatury oraz własną analizą wstępną [20]. Przyrost wskaźnika masy ciała w trakcie terapii insuliną był oceniany na podstawie parametru delta SDS-BMI, który wyliczono z różnicy bieżącej wartości SDS-BMI i wyjściowego SDS-BMI.
Uzyskane dane odnoszono do norm dla dzieci polskich w tym siatek centylowych zgodnych z płcią, wiekiem i wzrostem badanych. Nadwaga została zdefiniowana jako SDS-BMI > 1 (tj. > 85 centyla), otyłość – SDS-BMI > 2 (tj. > 95 centyla) [4]. Obecność otyłości centralnej określano na podstawie obwodu talii powyżej 90 centyla [21]. Nadciśnienie tętnicze rozpoznawano, gdy wartości ciśnienia skurczowego/rozkurczowego przekraczały 95 centyl [22]. Wyniki badań laboratoryjnych były odnoszone do zaleceń Polskiego Towarzystwa Diabetologicznego z 2010 r. W grupie dzieci z cukrzycą dodatkowo zanotowano informację o zastosowanym preparacie insuliny (insuliny ludzkie o krótkim i pośrednim czasie działania, analogi krótko- i długodziałające).
Genotypowanie
Do genotypowania pobierano 0,5 cm3 krwi obwodowej przy okazji badań laboratoryjnych koniecznych do diagnostyki pacjenta. Polimorfizm FTO rs9939609 oznaczono u wszystkich dzieci metodą dyskryminacji alleli na aparacie ABI 7900HT Fast Real-Time PCR System z oprogramowaniem SDS 2.1 (Applied Biosystems, Foster City, CA, USA). Wariant A/T badano korzystając z walidowanych, komercyjnie dostępnych sond zawartych w TaqMan SNP Genotyping Assay (Assay ID C__30090620_10, Applied Biosystem) znakowanych barwnikiem na końcu 5’ (odpowiednio VIC/FAM). Materiał DNA wyizolowano z pełnej krwi żylnej przy użyciu TaqMan Sample-to-SNP Kit (Applied Biosystems) zgodnie z instrukcją producenta. Reakcję przeprowadzono na płytkach 384-dołkowych w objętości 5 μL, mieszanina zawierała 1 μL materiału DNA, 2,5 μL TaqMan GTXpress Master Mix (Applied Biosystems), 0,25 μL TaqMan Genotyping Assay Mix 20x (Applied Biosystems) oraz 1,25 μL wody wolnej od DN-az. Zastosowano następujący profil termiczny reakcji: denaturacja wstępna 95°C przez 10 min.; 40 cykli następujących kolejno: denaturacja 92°C przez 15 s; hybrydyzacja/elongacja 60°C przez 60 s. Celem kontroli kontaminacji na każdej płytce reakcyjnej wprowadzono próby negatywne zawierające wodę zamiast materiału DNA. Zanotowano 99,3% prawidłowych reakcji.
Analiza statystyczna
Częstość alleli i genotypów w badanej populacji została ustalona poprzez zliczanie genotypów.
Następnie otrzymany rozkład genotypów w całej badanej populacji oraz osobno w grupie pacjentów z cukrzycą i grupie kontrolnej został porównany z dystrybucją przewidywaną zgodnie z prawem Hardy’ego–Weinberga (test χ2 Pearsona). Zmienne ciągłe porównywano używając nieparametrycznego testu rank Wilcoxona w przypadku dwóch grup badanych lub testu Kruskalla–Wallisa w przypadku więcej niż dwóch porównywanych grup. Do porównania zmiennych dyskretnych posłużył test χ2 Pearsona. Ryzyko względne oszacowano wyliczając iloraz szans (OR) z 95% przedziałem ufności (95% CI) przy użyciu bezwarunkowej analizy regresji logistycznej. Hipoteza, że polimorfizmy są związane z parametrami charakteryzującymi pacjentów, była testowana zakładając różne relacje między allelami (kodominujący i recesywny model genetyczny). Zmienne w skali interwałowej przedstawiono jako średnia arytmetyczna ± odchylenie standardowe. Dwustronne p < 0,05 wyznaczało poziom istotności statystycznej. Wszystkich obliczeń dokonano przy użyciu programu R-project (wersja 2.11.1, 2010; The R Foundation for Statistical Computing, Vienna, Austria). Rysunek wykonano w programie Excel for Windows.
Wyniki
Nadwaga, otyłość oraz cechy zespołu metabolicznego występują często u dzieci z cukrzycą typu 1
Dzieci z grupy badanej nie różniły się od dzieci z grupy odniesienia w zakresie rozkładu wieku (mediany 14 lat), płci oraz wzrostu (p > 0,05). Zgodnie z oczekiwaniami oraz danymi z poprzednich analiz tej grupy pacjentów nadwaga, otyłość oraz cechy zespołu metabolicznego były częstsze u dzieci z cukrzycą w stosunku do dzieci z grupy odniesienia. Odpowiednie wartości dotyczące dzieci z cukrzycą i bez cukrzycy wynosiły: dla nadwagi 83 (15,0%) vs 33 (8,1%) dzieci, dla otyłości, 56 (10,1%) vs 2 (0,5%) dzieci, dla otyłości centralnej 98 (17,7%) vs 30 (7,4%) pacjentów. W grupie dzieci z cukrzycą typu 1 wzrost wartości standaryzowanego wskaźnika masy ciała 3–6 mies. od rozpoznania schorzenia do momentu bieżącego badania był istotny statystycznie: mediany SDS-BMI 0,12 vs 0,58 (p < 0,0001). Zaburzenia gospodarki lipidowej również były częstsze w grupie badanej w porównaniu z grupą odniesienia – odpowiednio: całkowite stężenie cholesterolu 230 tj. 41,5% vs 85 tj. 20,9%, obniżone stężenie frakcji HDL-cholesterolu 98 tj. 17,7% vs 46 tj. 11,3%, podwyższone stężenie frakcji LDL-cholesterolu 178 tj. 32,1% vs 81 tj. 20,0%, podwyższone stężenie triacylogliceroli 40 tj. 7.2% vs 15 tj. 3.7%. Cechy nadciśnienia tętniczego zanotowano u 71 tj. 12,8% dzieci z cukrzycą oraz 35 tj. 8,6% dzieci bez cukrzycy. Kryteria zespołu metabolicznego spełniało 26 tj. 4,7% dzieci z cukrzycą (3 kryteria poza hiperglikemią) oraz 5 tj. 1,2% dzieci z grupy odniesienia. Nie zanotowano istotnych różnic w opisanych parametrach pomiędzy dziećmi leczonymi z użyciem poszczególnych preparatów insuliny (aspart vs lispro vs insuliny ludzkie krótkodziałające oraz detemir vs glargine vs insuliny ludzkie o pośrednim czasie działania).
Polimorfizm rs9939609 genu FTO jest związany ze wskaźnikiem masy ciała u dzieci bez cukrzycy
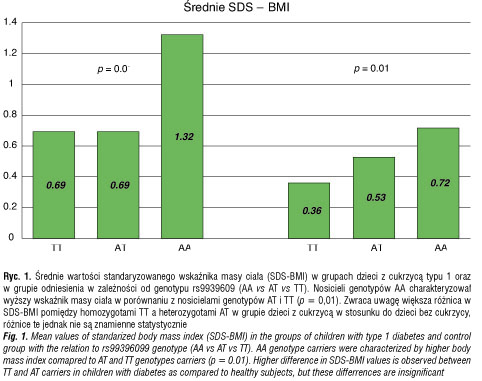
Wśród dzieci z grupy odniesienia częstość allelu A wynosiła 54%, a allelu T – 46%. Rozkład genotypów przedstawiał się w sposób następujący: AA – 126 tj. 31,1%, AT – 186 tj. 45,9% oraz TT – 93 tj. 22,9% (rozkład zgodny z prawem Hardy’ego–Wienberga). Polimorfizm genu FTO był związany ze standaryzowanym wskaźnikiem masy ciała, SDS-BMI (χ2 = 9, df = 2, p = 0,011). U dzieci z genotypem TT średnie SDS-BMI wynosiło 0,69 i nie różniło się od wartości tego parametru u heterozygot AT (średnia 0,69, p = 0,99). Natomiast u dzieci z genotypem AA SDS-BMI było istotnie statystycznie wyższe i wynosiło 1,32, p = 0,019. Przy założeniu recesywnego modelu dziedziczenia nosicieli genotypu AA charakteryzowało wyższe ryzyko otyłości (OR = 1,75; 95% CI 1,09–2,82, p = 0,02) w stosunku do nosicieli genotypów AT i TT.
Polimorfizm FTO był również związany z obwodem talii (przy założeniu recesywnego modelu dziedziczenia 79,9 vs 73,4, p = 0,003, odpowiednio dla AA i AT+TT), wartościami skurczowego ciśnienia tętniczego (przy założeniu recesywnego modelu dziedziczenia 122 vs 114,6 mmHg, p = 0,008, odpowiednio dla AA i AT+TT) oraz stężeniem triacylogliceroli (przy założeniu recesywnego modelu dziedziczenia 112,6 vs 96,4, p = 0,04, odpowiednio dla AA i AT+TT). Nie obserwowano natomiast asocjacji z ciśnieniem tętniczym rozkurczowym (przy założeniu recesywnego modelu dziedziczenia 73,4 vs 73,2, p = 0,87, odpowiednio dla AA i AT+TT)), całkowitym stężeniem cholesterolu (177,1 vs 170,4,
p = 0,41), oraz frakcji HDL- (52,5 vs 52,6, p = 0,64) i LDL-cholesterolu (106,1 vs 99,5, p = 0,62).
Polimorfizm rs9939609 genu FTO jest związany ze wskaźnikiem masy ciała u dzieci z cukrzycą typu 1
Obecność rzadszego w badanej populacji (553 dzieci) allelu A wynosila 48%, a allelu T – 52%, natomiast rozkład genotypów przedstawiał się
w sposób następujący: AA – 135 tj. 24%, AT – 261 tj. 47%, TT – 157 tj. 28%. Obserwowany rozkład genotypów był zgodny z wyznaczonym na podstawie częstości allelicznych według prawa Hardy’ego–Wienberga (chi2 = 1,65, p = 0,2).
Polimorfizm genu FTO był związany ze standaryzowanym wskaźnikiem masy ciała, SDS-BMI (χ2 = 9, df = 2, p = 0,039). U dzieci z genotypem TT średnie SDS-BMI wynosiło 0,36 i nie różniło się istotnie od wartości u heterozygot AT (średnia 0,53, p = 0,16). Natomiast u dzieci z genotypem AA było istotnie statystycznie wyższe i wynosiło 0,72, p = 0,011. Związek pomiędzy polimorfizmem rs9939609 genu FTO a standaryzowanym wskaźnikiem masy ciała w grupach badanej i odniesienia przedstawia rycina 1. Przy założeniu recesywnego modelu dziedziczenia (homozygoty TT i heterozygoty AT vs homozygoty AA) nosiciele genotypu AA nie wykazywali się wyższym ryzykiem otyłości (OR = 1,19 (95% CI 0,66–2,14), p = 0,57) w porówaniu do nosicicieli co najmniej jednego allelu T. Nie obserwowano istotnych statystycznie różnic w dystrybucji genotypów pomiędzy dziećmi z prawidłową masą ciała a dziećmi z nadwagą (p > 0,05).
Polimorfizm w tej grupie pacjentów był również związany ze stężeniem triacylogliceroli (przy założeniu recesywnego modelu dziedziczenia 95,4 vs 83,0, p = 0,035, odpowiednio dla AA i AT+TT). Nie obserwowano natomiast asocjacji z obwodem talii (70,5 vs 69,2, p = 0,27), ciśnieniem tętniczym skurczowym (111,9 vs 111,6, p = 0,87) i rozkurczowym (przy założeniu recesywnego modelu dziedziczenia 70,0 vs 70,5, p = 0,63 odpowiednio dla AA i AT+TT), całkowitym stężeniem cholesterolu (178,2 vs 175,2, p = 0,45) oraz frakcji HDL- (64,1 vs 65,7, p = 0,41) i LDL-cholesterolu (92,2 vs 91,3, p = 0,79). Nie wykazano związku pomiędzy genotypem FTO a zmianą wartości standaryzowanego wskaźnika masy ciała (delta SDS-BMI), który obiektywnie wskazywał przyrost masy ciała w trakcie terapii insuliną.
Dyskusja
W związku z obserwowaną istotną częstością występowania czynników ryzyka chorób układu sercowo-naczyniowego wśród pacjentów z cukrzycą typu 1 poszukuje się metod identyfikacji osób zagrożonych tą patologią. Spośród wielu badanych metod rosnące znaczenie ma ocena podłoża genetycznego otyłości oraz cech z nią związanych. W naszych wstępnych badaniach po raz pierwszy w literaturze wykazaliśmy związek polimorfizmu rs9939609 genu FTO ze wskaźnikiem masy ciała u dzieci z cukrzycą typu 1. Oznacza to istnienie nowego czynnika rozwoju otyłości w tej grupie pacjentów. Być może w przyszłości genotypowanie stanie się jedną z metod oceny ryzyka rozwoju chorób cywilizacyjnych.
Częstość występowania nadwagi, otyłości oraz cech zespołu metabolicznego wśród dzieci z cukrzycą typu 1 jest różna w zależności od przyjętych metod badawczych. W dużym badaniu niemieckim stwierdzono obecność przynajmniej jednego czynnika ryzyka chorób układu sercowo-naczyniowego u ponad połowy spośród 27 tysięcy dzieci z cukrzycą typu 1 [16]. Podobnie jak w naszych badaniach, najczęściej występowały otyłość oraz podwyższone stężenie cholesterolu całkowitego. Wyższy odsetek występowania otyłości brzusznej u dzieci z cukrzycą w porównaniu z dziećmi zdrowymi zanotowała w swoich badaniach również Szadkowska i wsp. [17]. Dzieci z cukrzycą typu 1 oraz towarzyszącą nadwagą/otyłością charakteryzowało częstsze występowanie nadciśnienia, zespołu metabolicznego oraz podwyższonej aktywności aminotransferazy alaninowej [18]. W grupie dzieci z nieprawidłowym wyrównaniem metabolicznym obserwowano znacznie wyższe odsetki pacjentów ze średnimi wartościami ciśnienia krwi powyżej normy dla wieku, np. w dzień 47%, a w nocy 74% [23]. Dane te uzyskano za pomocą 24-godzinnego monitorowania ciśnienia krwi. Nowością naszej analizy jest kwalifikacja do grupy badanej wyłącznie dzieci leczonych nowoczesnymi metodami, tj. funkcjonalną insulinoterapią z użyciem penów lub osobistej pompy insulinowej. Wśród badanych nie było dzieci leczonych metodą konwencjonalną. Jak wykazano w naszej poprzedniej pracy, dzieci leczone za pomocą pompy nie różnią się jednak od dzieci leczonych penami w zakresie występowania nadwagi i otyłości, natomiast cechują się niższym odsetkiem dyslipidemii [24]. W obecnym badaniu nie obserwowaliśmy różnic w zakresie ocenianych parametrów pomiędzy grupami dzieci leczonymi z użyciem różnych preparatów insuliny. Zalecenia w dziedzinie zapobiegania chorobom sercowo-naczyniowym u młodych pacjentów z cukrzycą typu 1 koncentrują się na monitorowaniu wskaźnika masy ciała, wyrównania metabolicznego, ciśnienia krwi, mikroalbuminurii oraz gospodarki lipidowej [25]. W zależności od uzyskanych wyników stosuje się leczenie dietetyczne i/lub farmakologiczne.
Nasze wstępne wyniki wskazują na związek polimorfizmu genu FTO ze wskaźnikiem masy ciała oraz stężeniem triacylogliceroli zarówno u dzieci z cukrzycą, jak i w grupie odniesienia, natomiast związek z obwodem talii oraz wartościami ciśnienia skurczowego krwi wykazano wyłącznie u dzieci bez cukrzycy. Od czasu odkrycia genu FTO ukazało się wiele prac dotyczących jego wpływu na nadwagę, otyłość oraz cechy z nimi związane u dzieci i dorosłych. Z analizy piśmiennictwa wynika, że nosicielstwo jednego allelu A u dzieci prowadzi do wzrostu standaryzowanego wskaźnika masy ciała o 0,08–0,12 jednostki i wzrostu 1,27–1,35 ryzyka otyłości (przegląd piśmiennictwa [26]). Podobne zależności dotyczą obwodu talii, grubości fałdów skórnych oraz zawartości tłuszczu w organizmie [7, 27–29]. Wpływ polimorfizmu genu FTO na wartości ciśnienia tętniczego krwi obserwowano w populacji francuskojęzycznych mieszkańców Kanady [30]. Trudno jest określić wiek, w którym wpływ ten się rozpoczyna oraz okres najsilniejszego wpływu genu FTO na cechy związane z otyłością. Zdaniem niektórych związek ten ujawnia się 2 tygodnie po urodzeniu, zdaniem innych w 7. roku życia, najsilniejszy jest w wieku 20 lat, potem jego efekt najprawdopodobniej słabnie [27, 31, 32]. Brak związku genotypu z niektórymi cechami towarzyszącymi otyłości, zanotowany u naszych pacjentów, może być spowodowany niewielką liczbą badanych dzieci oraz innymi parametrami wpływającymi na stan pacjenta z cukrzycą, takimi jak: wyrównanie metaboliczne, czas trwania choroby, dieta i inne. W dalszej analizie powyższe cechy będą wzięte pod uwagę.
Leczenie insuliną można z badawczego punktu widzenia rozpatrywać jako interwencję zastosowaną u dzieci z cukrzycą. Wpływ polimorfizmu genu FTO na interwencje terapeutyczne u pacjentów z otyłością (najczęściej próba zmiany stylu życia) nie jest znany, a wyniki niewielu badań w tym zakresie są sprzeczne [33, 34]. W naszej grupie nie obserwowaliśmy różnic w zakresie przyrostu masy ciała w trakcie terapii insuliną pomiędzy nosicielami alleli A i T w miejscu rs9939609.
Do dziś nieznana jest funkcja białka kodowanego przez gen FTO. Niektóre dane wskazują na większą częstość występowania epizodów utraty kontroli nad jedzeniem oraz upośledzone uczucie sytości u nosicieli alleli A, co może mieć istotny wpływ na masę ciała u pacjentów leczonych insuliną [12, 35]. Podobnie nosicielstwo alleli A koreluje z niską aktywnością fizyczną, co również może przyczyniać się do powstawania otyłości w cukrzycy [36]. Nie ma jednak przekonujących dowodów na obecność tych zależności u dzieci z cukrzycą.
W dostępnej literaturze nie napotkaliśmy na dane dotyczące związku podłoża genowego z pojawianiem się cech otyłości u pacjentów z cukrzycą autoimmunologiczną. Na obecnym etapie badań trudno jest określić, czy związek ten jest bardzo silny i czy ma istotne znaczenie kliniczne. W grupie kobiet z zespołem policystycznych jajników nosicielki homozygot AA w miejscu rs9939609 charakteryzowały wyższe o 1,56 kg/m2 wartości BMI w porównaniu do nosicielek homozygot TT, efekt ten u zdrowych kobiet wynosił tylko 0,46 kg/m2 [8]. Być może dalszych danych oraz ich interpretacji dostarczą badania na większej liczbie pacjentów zarówno z cukrzycą, jak i w grupie odniesienia. Poza genem FTO bada się efekt innych genów na rozwój czynników ryzyka chorób układu sercowo-naczyniowego, niektóre z nich będą przedmiotem kolejnych opracowań naszego zespołu [37].
Wnioski
Podsumowując, wyniki naszych wstępnych badań wskazują na związek polimorfizmu rs9939609 genu FTO ze wskaźnikiem masy ciała oraz niektórymi cechami towarzyszącymi otyłości zarówno u dzieci z cukrzycą typu 1, jak i u dzieci z grupy odniesienia. Związek ten wymaga potwierdzenia na większych grupach badanych, a efekty tych odkryć mogą przyczynić się do wyodrębnienia młodych pacjentów z cukrzycą zagrożonych wystąpieniem czynników ryzyka chorób układu sercowo-naczyniowego.
Piśmiennictwo
1. Małecka-Tendera E., Zachurzok-Buczyńska A., Gawlik A.; Management of childhood and adolescent obesity; Endokrynologia Pediatryczna 2009:8, 55-6
2. Barlow S.E., Commitee A.T.E.; Expert Commitee recommendations regarding the prevention, assessment, and treatment of child and adolescent overweight and obesity: summary report; Pediatrics 2007:120, S164-192
3. Cole T.J., Bellizzi M.C., Flegal K.M. et al.; Establishing a standard definition for child overweight and obesity worldwide: international survey; BMJ 2000:320, 1240
4. Kułaga Z., Różdżyńska A., Palczewska I. et al.; Siatki centylowe wysokości, masy ciała i wskaźnika masy ciała dzieci i młodzieży w Polsce – wyniki badania OLAF; Standardy Medyczne Pediatria 2010:7, 690-700
5. Hinney A., Vogel C.I.G., Hebebrand J.; From monogenic to polygenic obesity: recent advances; Eur. Child. Adolesc. Psychiatry 2010:19, 297-310
6. Zhao J., Bradfield J.P., Li M. et al.; The role of obesity-associated loci identified in genome-wide association studies in the determination of pediatric BMI; Obesity 2009:17, 2254-2257
7. Frayling T.M., Timpson N.J., Weedon M.N. et al.; A common variant in the FTO gene is associated with body mass index and predisposes to childhood and adult obesity; Science 2007:316, 889-894
8. Tan S., Scherag A., Janssen O.E. et al.; Large effects on body mass index and insulin resistance of fat mass and obesity associated gene (FTO) variations in patients with polycystic ovary syndrome (PCOS); BMC MED Genet. 2010:11, 12
9. Tews D., Fischer-Posovszky P., Wabitsch M.; FTO – friend or foe?; Horm. Metab. Res. 2010:42, 75-80
10. Timpson N.J., Emmett P.M., Frayling T.M. et al.; The fat mass- and obesity-associated locus and dietary intake in children; Am. J. Clin. Nutr. 2008:88, 971-978
11. Andreasen C.H., Andersen G.; Gene-environment interactions and obesity-further aspects of genomewide association studies; Nutrition 2009:25, 998-1003
12. Wardle J., Carnell S., Haworth C.M. et al.; Obesity associated genetic variation in FTO is associated with diminished satiety; J. Clin. Endocrinol. Metab. 2008:93, 3640-3643
13. Jarosz-Chobot P., Polanska J., Szadkowska A. et al.; Rapid increase in the incidence of type 1 diabetes in Polish children from 1989 to 2004, and predictions for 2010 to 2025; Diabetologia 2011:54, 508-515
14. Juliusson P.B., Graue M., Wentzel-Larsen T. et al.; The impact of continuous subcutaneous insulin infusion on health-related quality of life in children and adolescents with type 1 diabetes; Acta Paediatr. 2006:95, 1481-1487
15. Russell-Jones D., Khan R.; Insulin-associated weight gain in diabetes – causes, effects and coping strategies; Diabetes, Obesity and Metabolism 2007:9, 799-812
16. Schwab K.O., Doerfer J., Hecker W. et al.; Spectrum and prevelance of atherogenic risk factors in 27,358 children, adolescents, and young adults with type 1 diabetes; Diabetes Care 2006:29, 218-225
17. Szadkowska A., Pietrzak I., Szlawska J. et al.; Abdominal obesity, metabolic syndrome in type 1 diabetic children and adolescents; Pediatric Endocrinol. Diabetol. Metabolism 2009:15, 233-239
18. van Vliet M., van der Heyden J.C., Diamant M. et al.; Overweight is highly prevalent in children with type 1 diabetes and associates with cardiometabolic risk; J. Pediatr. 2010:156, 923-929
19. Magnussen C.H., Koskinen J., Chen W. et al.; Pediatric metabolic syndrome predicts adulthood metabolic syndrome, subclinical atherosclerosis, and type 2 diabetes mellitus but is no better than body mass index alone: the Bogalusa Heart Study and the Cardiovascular Risk in Young Finns Study; Circulation 2010:122, 1604-1611
20. Newfield R.S., Cohen D., Capparelli E.V. et al.; Rapid weight gain in children soon after diagnosis of type 1 diabetes: is there room for concern?; Pediatr. Diabetes 2009:10, 310-315
21. Kułaga Z., Litwin M., Zajączkowska M.M. et al.; Porównanie wartości obwodów talii i bioder dzieci i młodzieży polskiej w wieku 7–18 lat z wartościami referencyjnymi dla oceny ryzyka sercowo-naczyniowego – wyniki wstępne projektu badawczego OLAF (PL0080); Standardy Medyczne 2008:5, 473-485
22. Kułaga Z., Litwin M., Grajda A. et al.; Rozkłady wartości ciśnienia krwi w populacji referencyjnej dzieci i młodzieży w wieku szkolnym; Standardy Medyczne Pediatria 2010:7, 100-111
23. Szewczyk L., Bury A., Witkowski D.; Dobowy profil ciśnienia tętniczego u nastolatków z niedostatecznie wyrównaną cukrzycą typu 1; Endokrynologia Pediatryczna 2003:2, 29-32
24. Łuczyński W., Szypowska A., Głowińska-Olszewska B. et al.; Overweight, obesity and features of metabolic syndrome in children with diabete; Eur. J. Pediatr. 2011:170, 891-898
25. Krishnan S., Short K.R.; Prevalence and significance of cardiometabolic risk factors in children with type 1 diabetes; J. Cardiometab. Syndr. 2009:4, 50-56
26. Loos R.J., Bouchard C.; FTO: the first gene contributing to common forms of human obesity; Obes. Rev. 2008:9, 246-250
27. Hakanen M., Raitakari O.T., Lehtimaki T. et al.; FTO genotype is associated with body mass index after age of seven years but not with energy intake or leisure-time physical activity; J. Clin. Endocrinol. Metab. 2009:94, 1281-1287
28. Cecil J.E., Tavendale R., Watt P. et al.; An obesity-associated FTO gene variant and increased energy intake in children; N. Engl. J. Med. 2008:359, 2558-2566
29. Scuteri A., Sanna S., Chen W.M. et al.; Genome-wide association scan shows genetic variants in the FTO gene are associated with obesity-related traits; PLoS Genetics 2007:3, e115
30. Pausova Z., Syme C., Abrahamowicz M. et al.; A common variant of the FTO gene is associated not only with increased adiposity but also elevated blood pressure in French Canadians; Circ. Cardiovasc. Genet. 2009:2, 260-269
31. Hardy R., Wills A.K., Wong A. et al.; Life course variations in the associations between FTO and MC4R gene variants and body size; Hum. Mol. Genet. 2010:19, 545-552
32. Lopez-Bermejo A., Petry C.J., Diaz M. et al.; The association between the FTO gene and fat mass in humans develops by the postnatal age of two weeks; J. Clin. Endocrinol. Metab. 2008:93, 1501-1505
33. Rendo T., Moleres A., del Moral A.M.; Effects of the FTO gene on lifestyle intervention studies in children; Obes. Facts 2009:2, 393-399
34. Muller T.D., Hinney A., Scherag A. et al.; Fat mass and obesity associated gene (FTO): no singificant association of variant rs9939609 with weight loss in lifestyle intervention and lipid metabolism markers in German obese children and adolescents; BMC MED Genet 2008:9, 85
35. Tanofsky-Kraff M., Han J.C., Anandalingam K. et al.; The FTO gene rs9939609 obesity-risk allele and loss of control over eating; Am. J. Clin. Nutr. 2009:90, 1483-1488
36. Andreasen C.H., Stender-Petersen K.L., Mogensen M.S. et al.; Low physical activity accentuates the effect of the FTO rs9939609 polymorhism on body fat accumulation; Diabetes 2008:57, 95-101
37. Willer C.J., Speliotes E.K., Loos R.J.F. et al.; Six new loci associated with body mass index highlight a neuronal influence on body weight regulation; Nat. Genet. 2009:41, 25-34